中美为何对瑞德西韦结论相反 曹彬:中国指标更严格
2020-4-29 青野天润
柳叶刀:瑞德西韦治疗新冠中国重症患者无显著疗效
靴子落地。
4月29日,顶尖医学杂志《柳叶刀》在线正式发表了瑞德西韦第一项临床试验的数据结果。这是一项在中国湖北十家医院开展的,针对重症新冠肺炎(COVID-19)患者的随机、双盲、安慰剂对照的多中心试验。
简言之,这项临床试验结果显示,与安慰剂相比,接受瑞德西韦给药治疗并没有显著提高新冠肺炎患者的临床改善时间、死亡率或病毒清除时间。
换句话说,瑞德西韦的疗效不明显。
同日,吉利德和美国国立卫生研究院则同时发布公告称其临床试验显示瑞德西韦显示出积极的效果,且已达到其主要终点。接受瑞德西韦治疗的晚期患者康复速度快于接受安慰剂的患者。

由于新冠肺炎至今没有特效药物,疫苗仍在路上,从1月末2月初开始的这场关于瑞德西韦有没有效果的讨论几乎周周上热门。回顾一下瑞德西韦“成名史”,结果还是要靠严格的临床试验数据说话。
“成名史”
瑞德西韦(Remdesivir)是一种核苷酸类似物,一开始是吉利德公司针对埃博拉病毒开发的,但它对埃博拉的作用不明显。由于在体外和体内动物模型中证明了对SARS和MERS等病毒病原体均有活性,研究人员推测它对于此次的新冠肺炎也有效。
2020年1月19日,一名由武汉返美的35岁男子在华盛顿州确诊为新冠肺炎,后医生采用“同情用药”的方式对其注射了瑞德西韦,这名男子的临床状况得到大幅改善,瑞德西韦“一战成名”。
当时正是中国疫情焦灼的时期,中国的研究人员立即着手在武汉开展瑞德西韦针对新冠肺炎的临床试验。2月2日,中日友好医院发布公告称:“中日友好医院在武汉疫区牵头开展瑞德西韦(Remdesivir)治疗2019-nCoV新型冠状病毒临床研究,为抗击疫情带来曙光。”
中日友好医院呼吸与危重症医学科主任曹彬团队在武汉发起了两项试验,根据ClinicalTrials.gov注册信息显示,针对重症和轻中症的两项试验注册日期分别为2月6日和2月5日。其时预期结束时间为4月底。
随着疫情在全球的扩散,瑞德西韦相继在美国和全球其他疫情严重的国家展开临床试验,其中既有研究者发起,也有吉利德自己发起的临床试验。
在全球翘首以盼瑞德西韦“揭盲”的时候,4月10日,针对瑞德西韦在全球的进展,吉利德科学董事长兼首席执行官Daniel O’Day发布了一封公开信,称目前瑞德西韦有七项临床试验已经启动,预计在4月底获得瑞德西韦针对重症患者研究的初步数据,但在中国“因入组停滞,针对重症患者的研究已停止。”
同时吉利德在《新英格兰医学杂志》上发布一项瑞德西韦(remdesivir)针对重症新冠病毒肺炎患者采用同情用药(compassionate use)的治疗结果。在接受同情使用瑞德西韦治疗的严重Covid-19住院患者中,在总共53例患者中,有36例(68%)观察到临床改善。但缺乏对照组试验,数据存在局限性。
4月15日,曹彬团队更新了这两项试验在全球最大的临床试验登记中心上的信息,重症状态更新为“终止”,轻中症状态更新为“暂停”,理由均为“COVID-19的流行在中国已经得到很好的控制,目前没有符合条件的患者可以被纳入。”
由于瑞德西韦被寄予厚望,吉利德市值在2020年一季度上涨14.5%,股价触及新高。
戏剧性始于一周前的4月23日,由于世卫组织的一次“误操作”让中国临床试验结果提前意外曝光,称其疗效令人失望,本来走势良好的吉利德当天股价盘中突然跳水,一度下探超过8%,收跌4.34%。
这项试验即为此次《柳叶刀》发布的结果。当天吉利德全球首席医疗官Merdad Parsey代表公司紧急发布声明称,“我们认为那篇文章包含了对研究的不恰当描述。由于入组率低,该研究被提前终止,因此,它的数据不足以支撑有统计意义的结论。”
一周后,《柳叶刀》发布了曹彬团队的“不尽如人意”的试验结果,而美国国立卫生院和吉利德坚持称瑞德西韦仍旧有效果。
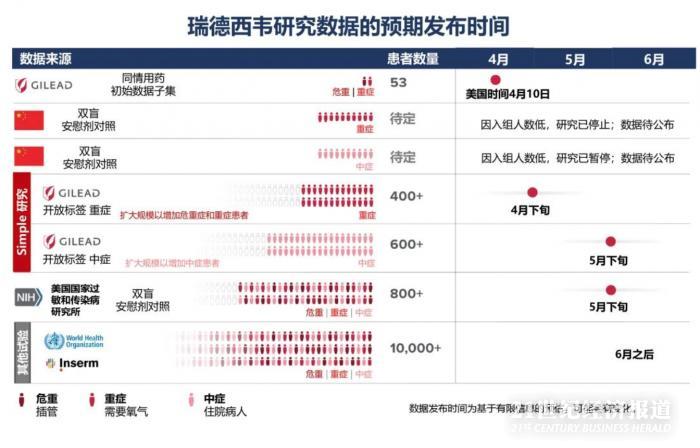
根据吉利德发布的时间表,后续还有多项临床试验将公布结果。
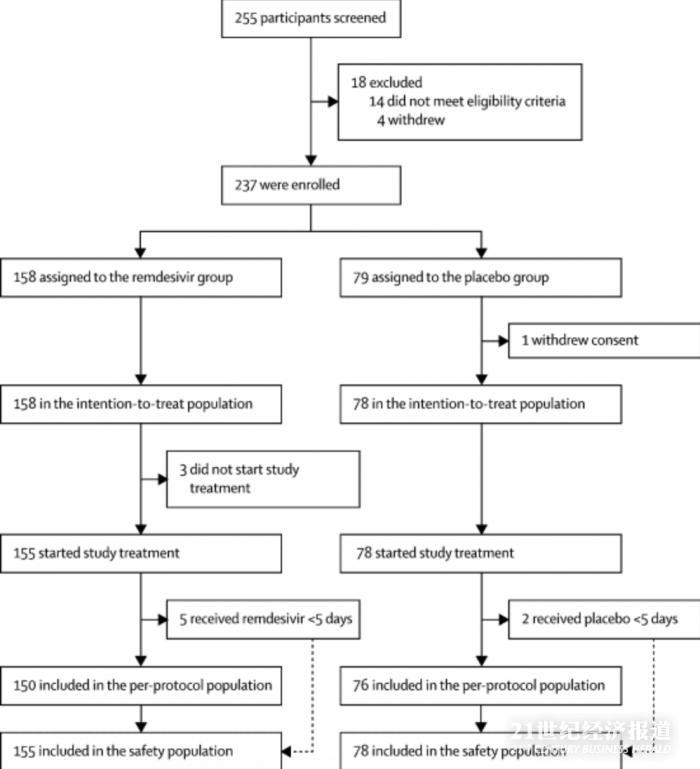
曹彬团队在中国湖北的十家医院进行了一项随机、双盲、安慰剂对照的多中心试验。符合条件的患者是入院后经实验室确诊的SARS-CoV-2感染的成年人(≥18岁),从症状发作到入组间隔为12天或更短,室内空气或血液中氧饱和度不超过94%,动脉血氧分压与吸入氧分压不超过300 mm Hg的比率,以及放射学确定的肺炎。
而后随机将患者以2:1的比例随机分配给瑞德西韦静脉注射(第1天200 mg,然后在第2-10天100 mg,每日一次输注),或相同剂量的安慰剂输注10天。允许患者同时使用lopinavir–ritonavir,干扰素和皮质类固醇。
主要临床终点是随机分组后28天内达到临床改善的时间。临床改善被定义为按六点顺序量表将患者的入院状况降低两点,或从医院实时出院,以先到者为准。
六点量表如下:死亡= 6;体外膜氧合或机械通气入院= 5; 无创通气或高流量氧气疗法入院= 4;氧气治疗入院(但不需要大流量或无创通气)= 3;入院但不需要氧气治疗= 2; 并已出院或已达到出院标准(定义为临床恢复即发热正常,呼吸频率<每分钟24次呼吸,室内空气中的外周血氧饱和度> 94%,和咳嗽缓解,均维持至少72 h)= 1。
在2020年2月6日至2020年3月12日之间,筛选了255位患者,其中237位符合条件入组。158例患者接受了瑞德西韦治疗,79例接受了安慰剂治疗。安慰剂组中的一名患者在随机分组后撤回了先前书面知情同意书,因此意向治疗患者群(ITT)中包括158名和78名患者。
3月12日之后,由于武汉市爆发疫情得到控制,并且没有根据方案中指定的终止标准,因此没有患者入组。数据安全和监控委员会建议终止研究,并于3月29日对数据进行分析。
结果显示,使用瑞德西韦与改善临床疗效的时间无关(HR=1.23, 95% CI,0.87-1.75)。两组的28天死亡率相似(瑞德西韦组22例死亡[14%]安慰剂组为10(13%);差1•1%[95%CI -8•1至10•3])。但在症状持续时间为10天或更短的患者中,接受瑞德西韦治疗的患者在临床上改善的时间要比接受安慰剂治疗的患者快得多(HR=1.52,95% CI,0.95-2.43)。
在155名接受瑞德西韦治疗的患者有102名(66%)发生不良事件,78名安慰剂接受者中有50名(64%)发生不良事件。瑞德西韦组最常见的不良反应是便秘,低白蛋白血症,低钾血症,贫血,血小板减少和总胆红素升高。在安慰剂组中,最常见的是低白蛋白血症,便秘,贫血,低钾血症,天冬氨酸转氨酶升高,血脂升高和总胆红素升高。
研究人员认为,在这项针对重度新冠患者住院的成年患者的研究中,瑞德西韦没有表现出统计学上显著的临床获益。然而,较早治疗者中临床改善时间的数量减少需要更大的研究证实。
尽管在冠状病毒感染的临床前模型中显示出强大的抗病毒作用,但在本研究中,瑞德西韦没有导致SARS-CoV-2 RNA载量或上呼吸道或痰标本的可检测性显著降低。研究发现瑞德西韦具有足够的耐受性,未发现新的安全隐患。此外,对于重度新冠患者,更长的疗程和更高剂量的瑞德西韦是否有益,尚无答案。
吉利德和NIH的说法
更具有戏剧性的是,4月29日,吉利德和美国国立卫生研究院(NIH)下属美国国家过敏和传染病研究所(NIAID)分别发公告称其所开展的瑞德西韦临床试验显示出积极效果。
吉利德宣布的是一项开放标签的3期SIMPLE试验的主要结果,该试验评估了住院严重COVID-19疾病患者接受瑞德西韦5天和10天给药时间的结果:瑞德西韦5天给药方案较10天给药方案显示出相似的临床改善。并且,越早接受瑞德西韦治疗的患者临床改善情况越好(发病10天内和10天后接受治疗的患者第14天出院比例分别为62%和49%)。
NIAID的研究则是一项涉及1063名患者的随机对照试验的初步数据分析,该试验从2月21日开始,接受瑞德西韦的新冠肺炎晚期住院患者的康复速度快于接受安慰剂的类似患者。
负责监督试验的独立数据和安全监视委员会(DSMB)于4月27日举行会议,以审查数据并与研究小组共享其中期分析结果。基于对数据的审查,他们指出,从主要终点、恢复时间(这是流感试验中常用的一种指标)的角度来看,瑞德西韦优于安慰剂。本研究中的恢复被定义为足以出院或恢复正常活动水平。
初步结果表明,接受瑞德西韦的患者的康复时间比接受安慰剂的患者快31%(p <0.001)。接受瑞德西韦治疗的患者的中位恢复时间为11天,而接受安慰剂的患者为15天。结果还显示了生存益处,接受瑞德西韦组的死亡率为8.0%,而安慰剂组的死亡率为11.6%(p = 0.059)。
受该消息提振,吉利德当日盘中大涨超过8%,市值过千亿美元。也有华尔街分析师认为,FDA可能会因此加速批准瑞德西韦上市。

吉利德:瑞德西韦美国试验达终点 结果数据积极
4月29日,吉利德官网公布新的关于瑞德西韦临床试验结果。
吉利德科学公司关于美国过敏和传染病研究所研究抗病毒药物瑞德西韦用于COVID-19的积极数据的声明。
吉利德了解到来自美国过敏和传染病研究所(NIAID)对抗病毒药物瑞德西韦治疗COVID-19的研究得出的积极数据。我们了解该试验已达到其主要终点,并且NIAID将在即将举行的简报中提供详细信息。
Remdesivir尚未在全球任何地方获得许可或批准,并且尚未被证明对COVID-19的治疗是安全或有效的。吉利德不久后将在该公司的开放标签3期SIMPLE试验中与重度COVID-19疾病患者共享其他remdesivir数据。这项研究将提供信息,说明较短的5天治疗时间是否具有与NIAID试验和其他正在进行的试验中评估的10天治疗疗程相似的疗效和安全性。吉利德(Gilead)预计第二次SIMPLE研究将在5月底评估中度COVID-19疾病患者的remdesivir的5天和10天给药时间。
吉利德将继续与监管机构讨论有关瑞德西韦作为COVID-19潜在治疗药物的数据集。

中美为何对瑞德西韦结论相反 曹彬:中国指标更严格
VIA:第一财经
权威医学期刊《柳叶刀》4月29日发表了全球首项关于吉利德在研抗病毒药物瑞德西韦的随机双盲对照组、多中心临床试验论文,显示瑞德西韦对于重症患者无显著疗效。
权威医学期刊《柳叶刀》4月29日发表了由瑞德西韦中国临床试验负责人、中日友好医院副院长曹彬教授和北京协和医学院院校长王辰院士所写的,关于全球首项关于吉利德在研抗病毒药物瑞德西韦的随机双盲对照组、多中心临床试验论文,显示瑞德西韦对于重症患者无显著疗效。
同一天吉利德科学公司发布其针对397名患者的开放标签临床III期试验结果显示,瑞德西韦早期治疗效果显著,超过一半患者在两周内出院。
美国国家过敏与传染病研究所(NIAID)所长安东尼•福奇当天表示,瑞德西韦临床试验数据积极,显著缩短了病人恢复的时间,将成为新冠治疗的新标准。
针对中美临床试验为何出现截然相反的结果,瑞德西韦中国临床试验负责人曹彬教授向第一财经记者独家表示,研究终点不同导致了结果的差异,中国的研究设计更严格。
《柳叶刀》最新发表的瑞德西韦首项临床试验论文的通讯作者为中日友好医院副院长曹彬教授和北京协和医学院院校长王辰院士。在对2月6日至3月12日期间招募的237名来自武汉10家医院的重症患者进行临床试验后,研究作者通过预先确定的临床试验主要终点得出结论,瑞德西韦用药与临床症状的改善关系不大。
从28天死亡率来看,瑞德西韦组和对照组分别为14%和13%;两组的副作用比例分别为66%和64%。此外,临床试验结果还显示临床症状改善的风险率(HR)为1.23。
论文称,尽管没有统计学显著性,但是根据预先确定的次要终点发现,与标准治疗的安慰剂组相比,接受瑞德西韦治疗的患者在出现症状后的10天内临床改善时间和有创机械通气时间缩短。
“次要终点和亚组分析不能改变研究的主要结论。”曹彬教授在论文发表后对第一财经记者表示。
曹彬教授向第一财经记者指出,这是一项设计合理的双盲、安慰剂对照、多中心随机试验。项目执行过程非常严格,极少失访。临床试验结果表明,与安慰剂对照组相比,未观察到瑞德西韦可以加快住院患者的病情恢复或降低死亡率。此外,病毒学方面,与安慰剂对照组相比,未观察到瑞德西韦可更快降低上、下呼吸道标本中的病毒载量。
基于上述结论,研究作者认为,今后的研究需要确定瑞德西韦在更早期、更高剂量或与其他抗病毒药或新冠保护性抗体联合治疗重症患者是否有效。
瑞德西韦中国临床试验设计入组重症患者453名,但最终因入组样本数量不足,试验于4月16日提前终止。
《柳叶刀》在发表瑞德西韦中国临床试验论文时,同时刊登了一篇由爱丁堡大学医疗数据主席约翰•诺里(John Norrie)教授撰写的题为《动力不足的临床研究的挑战》的评论文章。
诺里教授指出:“缺乏足够的临床试验数据的支撑意味着试验的发现不具有结论性意义。但在大流行病的背景下,数据分享尤其重要,能够快速管理相关的数据集。”
他还强调,高质量的随机试验的重要性,认为必须严格确认或者驳斥观察性数据释放出的积极信号,尤其是在疾病疗法的安全性和有效性尚未被验证的情况下。
研究终点不同导致相反结论
就在《柳叶刀》发表瑞德西韦中国临床数据的同一天,4月29日,吉利德科学公司向外释放积极信号,公布了两个好消息,一是来自美国国立卫生研究院(NIH)的临床试验已经达到主要终点,并且数据正面;二是公布了吉利德开放标签的临床试验,显示至少一半患者接受治疗5天后临床症状改善、出院,并且接受5天用药和10天用药疗效相似。除意大利外,两组患者14天死亡率都只有7%。
美国NIH对全球大约1090名患者展开的随机双盲对照临床试验显示,31%的患者在用药后症状出现改善。瑞德西韦治疗组的恢复时间为11天,对照组的恢复时间是15天;瑞德西韦组的死亡率是8%,对照组的死亡率是12%。NIAID所长福奇承认,死亡率的改善没有达到预期。
针对中美临床试验的结论为何出现截然相反的结果,曹彬教授对第一财经记者表示:“我们对用药时机有要求,时间窗口在症状出现后的12天以内,但最主要的不同是研究终点的不同,美国NIH的研究终点指标过松。如果我们使用这一指标,估计也是阴性结果。”
美国NIH和中国发表在《柳叶刀》的研究与设计均为双盲安慰剂对照临床(RCT),用药方案相同。“但是客观讲,中国瑞德西韦研究设计更加严格,科学性更强。”曹彬教授告诉第一财经记者。
从主要终点来看,美国NIH设计的指标为临床恢复时间,中国则是设计了基于6分量表的临床改善时间。“NIH的恢复定义比较宽泛,包括住院,但不需要氧疗、出院(但可能仍有活动受限、需要吸氧),相当于我们的1-2级+回家吸氧。”曹彬教授表示。
前美国FDA局长斯科特•戈特利布(Scott Gottlieb)表示:“瑞德西韦更像是新冠疾病治疗工具箱中的一部分,它不是特效药,但是如果能在患者感染的早期使用,可能会对控制疾病的发展有好处。”
新冠病毒全球确诊感染人数已经超过300万,死亡人数接近22万。在疫苗研发结果仍然需要等待相当长时间前,找到有效药物对控制疫情是至关重要的。
在这样的背景下,市场显然更愿意接受好消息。受吉利德宣布的临床试验结果提振,4月29日美股开盘后,吉利德在短暂停牌后,大涨近10%,吉利德近三个月股价涨幅超过30%。